生化学は19世紀の終わりごろから現在にかけて大きく発展した科学分野の1つです。中でも分子生物学の発展は目覚ましく、DNAや細胞の研究が進んだことでさまざまな生命現象のメカニズムが明らかになりました。
細胞培養はそのメカニズム解明と生命現象を利用する研究の一環として取り組まれてきました。ニュースでも話題になったES細胞やiPS細胞はその根幹となるもので、細胞培養をする上で欠かせない技術となっています。
今回はそんな細胞培養の原理や方法、フードテックとして食肉の生産に関わる細胞培養の現状、メリット・デメリットを紹介します。
細胞培養とは
現代の科学で細胞は生物における最小単位と考えられています。それは、細胞が生物と定義する上で必要と考えられている「外界との境界がある」「新陳代謝を行う」「自己複製能力を持つ」という3つの機能を備えているからです。
細胞培養を解説する上で重要なのは「自己複製能力」です。自分と全く同じ構造や機能を持つ細胞を自力で増やすことができる、細胞が元々持っているこの機能を利用しようというのが細胞培養の始まりです。
細胞培養のアイデアや技術は100年以上前からありますが、培養した細胞を利用するに過ぎませんでした。培養した細胞そのものを利用する技術にまで発展したのはES細胞やiPS細胞の発見が大きく影響しています。
細胞培養にかかわる原理
細胞は温度や物質などの条件さえ整っていれば放っておいても増殖します。ですが、単に細胞数を増やすだけでは目的の組織や器官を作ることはできません。ここには「分化」というプロセスが必要になります。
分化とは、細胞がさまざまな組織や器官の働きに合わせて構造や機能を変化させることです。ES細胞やiPS細胞といった幹細胞は「未分化細胞」であり、まだ分化が完了していないためにあらゆる組織や器官に分化できます。つまり、理論上は1つの細胞から皮膚、筋肉、臓器、骨を培養することができます。
ES細胞とiPS細胞
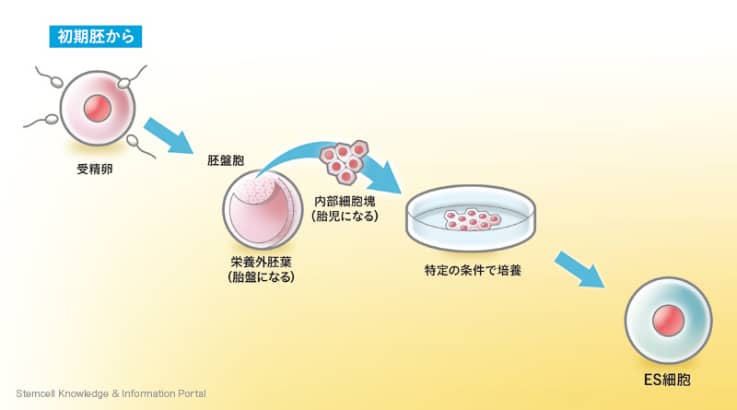
ES細胞(embryonic stem cells)は日本語では胚性幹細胞と呼ばれ、受精卵から発生が少し進んだ胚から取り出した細胞を用いて作成された幹細胞です。1981年にイギリスのエバンス教授がマウスを用いて作成したのが始まりです。その後、1998年にはアメリカのトムソンらがヒトでもES細胞の作成に成功しました。胚から作られたES細胞は理論上あらゆる器官や組織に分化することができることから、発見当時は「万能細胞」とも呼ばれていました。
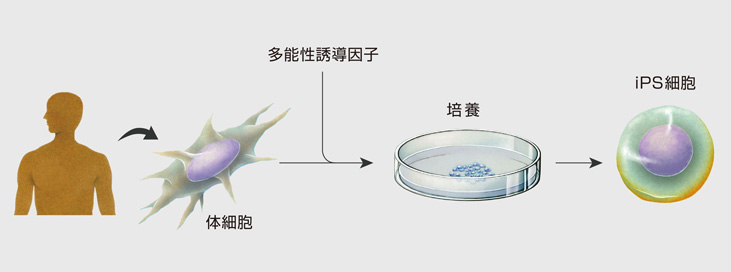
iPS細胞(induced pluripotent stem cell)は人工多能性幹細胞とも言われる、文字通り人工的に作られた幹細胞です。体細胞に4つの因子を導入することで細胞を未分化の状態に変えるリプログラミングを起こす技術は京都大学の山中伸弥教授によって2006年に発見され、2012年にノーベル医学・生理学賞を受賞しました。
ES細胞は発見された当初から「胚」という生命の初期段階を利用することに対して疑問を持つ人が少なくなく、また、ES細胞由来の組織は他者の細胞であるために移植などで拒絶反応が起こることも課題としてありました。
iPS細胞は既に成熟した体細胞から幹細胞を作成されるため、ES細胞の抱える胚細胞の倫理的な問題や拒絶反応を回避できると考えられており、現在も実用化に向けて世界中で研究が進められています。
細胞培養の方法

一般的な細胞培養では、アミノ酸、ビタミン、無機塩類、糖類などを含む基本培地に、血清や成長因子などを添加したものを培地として用います。この培地に対象の細胞を加えてpHや温度などの条件を整えると、細胞は増殖を開始します。
対象となる細胞や組織の種類、あるいは実験の段階に合わせてさまざまな培養の手法を用います。例えば、シャーレ上での培養で目的に合った細胞の選抜をして、その選抜された細胞をより大きな装置で効率よく培養するといった流れです。
培地や環境の条件や作業フローなどが確立できれば、培地がある限りでほぼ永久的かつ機械的に培養し細胞を増やすことが可能です。一方で、細胞の種類や分化させたい組織によって必要な栄養素や因子、あるいは適切な温度やpHなどの条件を確立するまでに場合によって莫大な時間とお金がかかることや、コンタミネーションの防止など、適切な細胞培養にあたって障壁になる要素は少なくありません。
細胞培養肉

人口増加によって近い将来に食糧が不足することが予想されている一方で、畜産については環境負荷や動物愛護の観点から批判が集まっています。したがって、効率がよく、環境負荷が小さく、動物に負担がないタンパク源の確保が1つの重要な課題となっています。培養肉はそんなタンパク源の確保の解決案の1つとして考えられています。
人口肉やタンパク源確保の海外の事例についても解説しています。
未来の食材・人工肉とは|知っておきたい概要や作り方を徹底解説!
代替タンパク質の世界の今|海外の取り組みを解説
現状
細胞培養肉について注目が集まったのは2013年です。世界初の人工肉バーガーの試食会で提供された、140gの人工肉のパティは開発に25万ユーロ(約3,300万円)以上がかかっていました。そこから8年経った現在は、培養肉産業に多くの企業が参入や投資をして、一般流通に向けた開発にかかるコスト減の取り組みをしています。
世界初、人工肉バーガーの試食会開催 「食感は完璧」(AFP BB News)
市場への流通については、シンガポールで2020年12月に世界で初めて培養鶏肉の販売が承認されました。培養鶏肉のGood Meat(グッドミート)はアメリカの企業Eat Just(イートジャスト)社がシンガポールの工場で開発した商品で、実験的にシンガポールのレストランでナゲットやグリル用の切り身として提供されます。
Eat Justが世界初の認証を取得しシンガポールで培養肉の販売を開始(TechCrunch Japan)
メリット

細胞培養肉は「クリーンミート」とも呼ばれており、畜産で生産される食肉に比べて完全無菌状態で製造できることから菌や添加物に汚染されていないことが由来とされています。畜産との比較では、CO2など温室効果ガスの排出量を抑えることができる、動物愛護の観点からも殺生の必要がない、などのメリットが考えられています。
細胞培養としてのメリットとしては、栄養価のコントロールも畜産に比べればはるかに容易であり、高たんぱくで栄養成分の含有量の高い肉の製造が可能になることや、世界中のどこであっても工場と素材を用意すれば生産できることが挙げられます。また、将来的に分化の技術が確立すれば、あらゆる部位の食肉が製造可能になります。
遺伝子操作で培養肉の栄養価を高める ータフツ大学がβ-カロテンを含む培養肉を生産(What’s NEXT)
デメリット

デメリットとして代表的なものに、「実験室で生まれた肉」という事実が消費者に受け入れられないというものがあります。先述した栄養価の向上のための遺伝子組み換えや添加物などは批判の対象になる可能性が否定できません。また、安全性の問題から販売の承認がおりないこと、開発コストが莫大であり製造、市場に出回るまでにはいくつもの障壁があります。
ほかにも、環境負荷について畜産の抱える問題は解決できたとしても、培養肉の製造工場が環境に負荷を与えない保証はどこにもありません。細胞培養が現状の畜産と同程度の産業まで発展したときに、培養に関わる物質の製造ラインや消費されるエネルギーが本当に持続可能であるかは現状では推測の域をでません。
細胞培養の将来
細胞培養という技術をフードテックの観点から解説してきましたが、細胞培養には医療分野での発展が期待されています。日本ではiPS細胞から作製した角膜上皮細胞の移植手術が、海外ではiPS細胞と3Dプリンター技術を利用した人工心臓の製造実験が行われているなど、既に実用化に向けた取り組みが進んでいます。
世界初、iPS細胞から作製した角膜上皮細胞シートの第1例目の移植を実施(国立研究開発法人日本医療研究開発機構)
テルアビブ大学の研究チームは患者の細胞を利用した世界初の3Dプリント心臓を開発(3DP id.arts)
食品製造と医療分野でのデータや技術が相互に利用され、培養肉の製造や臓器培養の技術が平行して向上していくことで、細胞培養によるさまざまな技術の実用化と発展が期待されています。
まとめ
今回は細胞培養について解説しました。開発状況もまだまだ過渡期にありますが、フードテックだけでなく医療でも注目が集まっている分野であり、iPS細胞のように未来を大きく変える技術が確立されるのはそう遠くないかもしれません。培養肉にも課題はたくさんありますが、将来のタンパク源の選択肢として期待されている部分もあり、今後の細胞培養の発展に注目です。

